一般说来,液体按照缔合与非缔合的形式进行分类。弗斯林德(Forslind)曾设法阐述过这种分类,他指出:非缔合液体是一种在引力场所具有的强度支配下的有稳定角度分布的、分子间存在相互作用的液体;而缔合液体是一种成一定角度分布的分子引力场强度易于变化和有方向性的液体。在非缔合液体中,分子的相互作用通常导致了紧密堆积的排列,但在缔合液体中,分子的相互作用发生在最佳的方向上,所以这些液体一般都改变了其紧密堆积的状态。水是一种缔合液体,它的分子是一种有最佳结合方向的特殊形状的分子。如果水分子的形状决定了它的化学结合力,而又影响到水本身的性质,那么就必须研究这种水分子的结构。这里有另一个特殊情况出现,氧原子的电子结构支配着整个水分子的电子结构。当人们考虑到水分子是由三个原子组成时,这种情况是非常独特的。无疑,水的这种不寻常的情况是由于一个氧原子与两个氢原子结合后,每个氢原子给出仅有的一个电子,在结构中有氢核存在。
此时,观察一下氧原子的电子结构。李纳特和波尔用统计量子力学的方法,计算了在氧原子周围的电子构造形式。氧原子核包括的电子是1S2,2S2,2PZ2,2PX1,2PY1。他们假设,两个K层(1S2)的电子是对称地定位在氧核+8周围;因此,这种K层电子不能对原子特有的形状产生影响。更确切地说,围绕原子核的球形表面上1S电子发现的几率在所有可能的条件下是最大的。因为L层电子,即2S和2P有相对小的能级差,发现它们是以混杂状态相混合。经计算,两对电子和两个孤独电子在原子核外部空间四个确定的方向上最有可能出现,如图60所示,这四个方向的位置处于两个垂直的平面上,例如A和B。这两个平面在点0处相交,这一点代表着氧原子核的中心。处于水平面B上的两个杂化电子对之间的角度经测定为133.5º,处于垂直面A上的两个孤独电子对之间的角度是103º。
要绘制水分子的电子构造形式,即需要在垂直平面A上放入来自于两个氢原子的两个电子,也就是在2PX的位置上,这里它们变成2PY电子,并且在垂直平面A,这两对电予的位置上增加了质子。此时,在两个带正电荷的质子之间的排斥力引起了在电子图形上的轻微变化,即从103º的角度增加到104.7º。一旦水分子形成之后,在空间上显现出接近于四面体的形状((4个面),一对电子在两个顶点上,而一对质子在另外两个顶点上,这在两个顶点上提供了强负电效应,在另外两个顶点上提供了强正电效应。
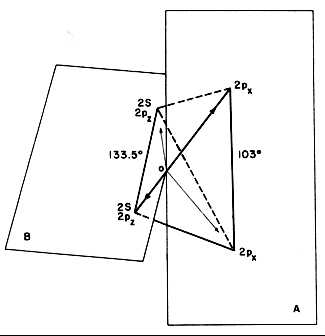
图60:氧原子的电子构形迹
如果我们现在按照化学结合的方式把两个水分子放在一起,一个四面体上的正电荷一端将会被吸引到另一个四面体负电荷的顶角上。当这种接触形成后,在两个四面体之间就建立了氢键,因为质子与两对电子此刻是缔合在一起的。
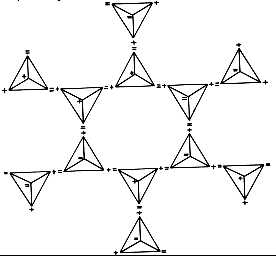
图61:冰结构的简图
如果若干更多的水分子引入到图形中,在接触点上每一个形成的氢键,在二维空间上形成了如图61所示的六角形排列。这一简图表示了冰的结晶结构,人们必须认识到四面体中各自独立的顶角,某些是指向上边的,某些是指向下边的。通过这些点建立的三维空间上的晶体,形成了六角形的冰的结构(注:与冰的结构相类似的硅氧四面体共用顶角的硅一氧结构图如前文中所示)。氧的原子核处于所表示的水分子四面体的中心。人们能够从图61看到,这就是为什么雪花呈现出美丽的六角形图案的原因。
要真正地表示液态水的结构是非常困难的,因为在具有许多空穴或许多空位的冰的结构消失后,水的分子是处于一种动态的、连续变化其排列的过程中。回忆前述的液体是在固体结构和气体结构间的转换状态,就会清楚的看到,水的结构在0~100℃之间的各种温度下是不同的。事实上,摩根 (Morgan)和汪林(warren)由水的X射线衍射圈,计算出了任一给定的分子最接近的相邻分子的数目以及它们之间的距离,他们发现,即在其数量和距离上均随着温度的增加而增加,如表28所示。考虑到所有这些不便,图62表示了可能是三维空间的,在冰点之上不远处某个温度时水分子的瞬时排列。冰的六角形结构消失,产生了更小的未占用空间,直到热膨胀再一次使水分子相隔更远。这就解释了为什么冰在水中漂浮及为什么水在4℃时密度最大。在图62中标出的X点是为了引起对残留原始冰的结构的注意。而O点的位置是指那里存在着空位。(为了清楚起见,在绘制这一图形时采取了任意绘制的简图)。
表28:在冰和水中水分子的配位
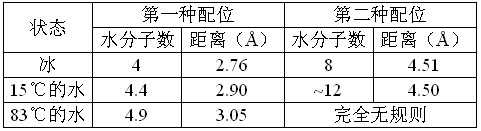

图62:水的结构简图
版权所有:【河南欧帕工业机器人有限公司】
本站所有内容受知识产权保护 未经许可严禁转载、复制或建立镜像
中心地址:河南省郑开大道官渡组团 联系电话:0371-60863533
豫ICP备14017777号-3 营业执照 河南省互联网违法和不良信息举报中心

